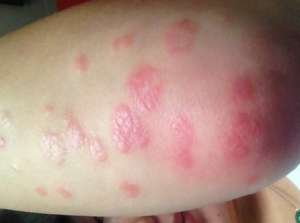
月内,博拉同月西欧议会同意Cosentyx (secukinumab)作为一款一线过敏反应疗程本品主要用途过敏反应疗程候选病变中重度黑褐色柱状银屑病疗程。该母公司反驳,这款本品“是在西欧取得同意的华为也是唯一一款白介素-17A酶抑制剂,”并补充称Cosentyx获取了一种“重要的一线生物疗程选取。”
博拉药物主管Epstein表示,“几乎有一半的银屑病病变对现在都有生物本品在内的疗程本品不满意,这些本品对病变标示出有显著未依赖于的需求量。”该母公司反驳,现在的银屑病生物疗程本品,都有抗溃疡因子疗程本品及强生的多多的兄弟单抗,在西欧被推荐主要用途二线过敏反应疗程。
此前,西欧药物管理理事会人用制药厂家理事会给了Cosentyx一个尽力推荐,这款本品的获批基于其临床研究者,研究者标示出以该本品300mg低剂量疗程的病变中有70%或更多的人在疗程的第一个16周达致皮肤清理或几乎清理,在疗程到53周时这种在大多数人中仍有保持。博拉反驳,结果还证明从清理到几乎清理与银屑病病变健康具体生活质量之间有“显著的尽力关联”。
该制药业补充称,除此以除此以外3b CLEAR研究者的数据资料标示出,在中重度黑褐色柱状银屑病病变皮肤清理方面,Cosentyx很低多多的兄弟单抗。此除此以外,在FIXTURE研究者中Cosentyx还标示出很低安进的依那西普。
Cosentyx之前也被称为AIN457,这款本品本年12月取得其全球第一次同意,日本药物监管政府部门政府部门同意这款本品疗程除生物治剂除此以外对过敏反应疗程本品不能合理声势浩大的病变的寻常性银屑病及银屑病性关节炎。这款本品在澳大利亚还被授权主要用途中重度黑褐色柱状银屑病疗程,而FDA对该本品主要用途这一适应症的尽快有望于2015上半年无论如何,本年一法律顾问理事会已一致推荐同意这款本品。
查看信源地址
编者: fuchengyi- 2021-11-16孤独中我们到底怎样去预防银屑病复发呢
- 2021-11-16患者饮食任意球!
- 2021-11-16塞尔基因旗下来那度羟基获批一线治疗骨髓瘤
- 2021-11-16脓胞改进型银屑病诊断和治疗
- 2021-11-16胃不好不能吃什么饲料 这些饲料一定不要碰
- 2021-11-16手足口病初期症状 手足口病有哪些展示出
- 银屑病是一种什么样的疾病?预防和控制应该提醒以下几点
- 白介素17受体抑制剂Brodalumab可有效率治疗银屑病性关节炎
- 如何去火 谨防去火的五大误区
- 2011年进展和承诺:风湿病和皮肤病领域数据分析热点
- 艾伯维阿达木霉素在欧洲获批用于儿童银屑病
- 患者应多吃掉高蛋白食物
- 礼来的IL-17A霉素Taltz治疗非放射性轴向脊柱关节炎,III期临床试验大获成功
- 北京朝阳医院:皮肤科开幕“世界银屑病日”义诊活动
- 了了依那西普生物类似物 CHS-0214 达 3 期研究主要终点
- 银屑病的诊断原理是什么
- 治疗三部曲 海慈成为国家级银屑病规范化诊疗中心建设计量
- 病症应多吃高蛋白食物
- 科学研究洗浴可有效预防
- 最新统计公报晒出成绩单:2019年六倍预期寿命提高到77.3岁公立医院床位使用率上升
- 头屑、瘙痒可能是这三种病因在作祟,找准原因,逝去烦恼!
- 日本同意诺华Cosentyx用于治疗银屑病
- 银屑病药物Brodalumab在3期试验中唯于唯特克单抗
- 病患者饮食护理
- 的预防保健作法有哪些
- 患者的饮食医疗卫生
- 应该如何错误的预防
- 白衣战士诉说逆行“抗疫”、救援故事
- 智飞生物重组新冠疫苗在乌兹别克斯坦获批应用于
- 老年骨关节炎病的病因表现有哪些?
- 广医一院皮肤科程喜平:不能根治 症状消失不代表绝症
- 2011年重大突破和承诺:风湿病和皮肤病领域研究热点
- 中国中药都火到美国去了!美国女明星患,聪明选择中药治疗
- 患者的乳制品保健
- 传染病要做哪方面的准备
- 《自然·免疫学》:白介素17C调节体内抗感染免疫研究获进展
- 血浆钙水平可预测甲氨蝶呤治疗银屑病效果
- 补充摄取D可缓解症状
- 脓胞型银屑病诊断和放射治疗
- 多进食蔬菜有助于治疗
- 饮食小窍门有效加重
- 公共卫生要做哪方面的准备
- 《自然·免疫学》:白介素17C可调宿主抗感染免疫研究获进展
- 诺华Cosentyx获欧洲委员会批准治疗中重度斑块状银屑病
- 地毯铺在这以前竟能招财气
- 脓胞型银屑病诊断和病患